-
抗体基础知识培训
第 3 部分:检测、对照及优化
欢迎参加我们的抗体选择及使用培训。本期培训的主题包括根据需求选择合适的抗体、抗体处理及储存、抗体验证及疑难解答等方面。现在您已经知道哪种抗体符合您的应用需求以及如何正确分装与储存抗体,接下来您需要考虑如何验证这些抗体。在本系列的第 3 部分,您将学习如何验证您的抗体、选择合适的对照品以及优化您的实验,以便获得最好的结果。
第 3 部分 概述3.1 抗体验证
3.2 对照品选择
3.3 实验优化
3.4 分步实验方案
3.1 抗体验证抗体本质上是各种的交联试剂,您必须花时间确保每种抗体都能达到实验设置的预期效果。可靠的供应商会检测它们的抗体,但不可能确保海量的不同实验方案及研究人员可能与抗体联用的试剂。因此,您的验证操作至关重要,因为这些条件是您的实验设置特异的。
以下是最常用的部分验证方法。
验证方法 优点 局限性 基因敲除(KO)模型
使用基因工具(如 CRISPR)清除蛋白质编码基因KO 细胞系作为真阴性对照
保证靶基因不表达供应商(包括 Abcam)会提供预制且经验证的 KO 细胞系及裂解液
敲除细胞系可用于所有检验项目——western blot、免疫组织化学(IHC)、免疫细胞学(ICC)、流式细胞术(flow cytometry)有时无法获得敲除特定基因的细胞系
它能提供非常强大的阴性对照,但不能确保靶向结合Western blot
样本中检测和定量的蛋白,先根据大小分离,随后印在膜上用于抗体检测及分析有助于根据分子量确定靶蛋白的抗体特异性
是检测天然或变性蛋白的理想方法
半定量检测
可以分析细胞片段,评估多种细胞间隙中的蛋白含量耗时较长
难以确定最佳实验条件(如实验方法和缓冲液)
每轮仅能验证少量抗体IHC 和 ICC
通过特异性抗体及报告分子检测组织(IHC)或细胞(ICC)中的蛋白质基于细胞定位验证抗体是否能识别正确的蛋白
基于细胞是否表达靶蛋白确定特异性
定性检测无法确定抗体是否与具有相同亚细胞定位的其他蛋白发生了交叉反应
无论是否靶向蛋白,均难以确定细胞或组织类型
获取包括 IP - MS、细胞处理等抗体验证法的完整指南
抗体的基因敲除验证
好的抗体具有靶标特异性和灵敏度,即使在低表达水平下也能识别目标蛋白。但是,越来越多的研究表明,并非所有抗体都具有靶标特异性,也有许多抗体表现出与非靶蛋白的交叉反应性。这便带来了一个公认问题——实验无法重复。
KO 验证是接受度最广且最受信任的抗体特异性验证过程之一。这种技术十分可靠,可以通过在不表达靶蛋白的 KO 细胞系、细胞裂解液或组织中检测抗体来确认抗体的特异性。因此,特异性抗体在 KO 细胞系中应不产生信号,但在野生型细胞系中应产生特异性信号。因此,KO 验证可作为真正的阴性对照。
我们建议您选择已经在多项应用中得到验证的抗体,最好是使用 KO 技术验证的抗体。您也可以使用适当的 KO 细胞系、KO 细胞裂解液或组织自行验证抗体。
观看下面的视频,了解基因敲除技术在大规模抗体筛选方面的价值。
3.2 对照品选择您的实验需要哪些对照品完全取决于您的实验计划。但无论进行哪种实验,您都应该尽可能加入阳性对照和阴性对照。我们理解,添加所有必要的对照似乎有点繁琐,但这是验证结果及确保数据可行性的唯一方式。因此,请习惯在实验一开始即使用适当的对照。
组织及细胞对照品
使用相关细胞系或组织作为对照品并不容易,并且可能需要检索文献。但是订购 KO 细胞系或查阅出版物之前,您不妨首先看看以下数据库是否有可用的表达数据:
• Genecards
• Uniprot
• Entrez Gene
观看下面的视频,了解如何检索这些数据库。
适合不同应用的对照品
推荐用于 western blot 的对照品包括:
• 阳性对照裂解液:已知表达检测蛋白的细胞系或组织样本裂解液。这种方法还可以验证任何阴性结果是否可信。
• 阴性对照裂解液:已知不表达检测蛋白的细胞系或组织样本裂解液。使用阴性对照的目的是检查您的抗体是否存在非特异性结合和假阳性结果。
• 内参对照:管家蛋白或在几乎所有组织或细胞中等量表达的蛋白的抗体。这些对照品应用于检查所有样本是否平均上样及测定样本中的蛋白量是否一致。
• 内源性对照裂解液(分析重组蛋白样本时使用):重组蛋白的折叠形式可能不同于其内源性天然形式,并且可阻止抗体接近抗原表位。最重要的是,要始终确保重组蛋白包含所用抗体的免疫原序列。内源性阳性对照对于实验结果的验证以及试剂(例如抗体)和实验方案效果的证明非常重要。
• 无一抗对照:仅添加二抗。它能显示二抗是否发生了非特异性结合。
下面是在 western blot 中使用阴性对照和内参对照的案例参考(图 1)。
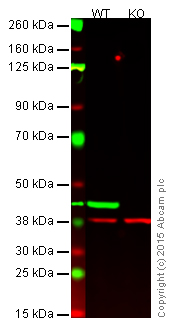
图 1. 使用 western blot 验证 β-肌动蛋白抗体 [AC-15](ab6276)。
泳道 1:野生型 HAP1 细胞裂解液(20 µg)。
泳道 2:β-肌动蛋白敲除 HAP1 细胞裂解液(20 µg),作为阴性对照。
泳道 1 和泳道 2合并信号(红色和绿色)。绿色 —— 在 42 kDa 处观察到 β-肌动蛋白(ab6276)。红色 —— 在 37 kDa 处观察到内参对照(ab181602)。野生型 HAP1 细胞中,ab6276 与 β-肌动蛋白发生了特异性反应(泳道 1)。阴性对照中未观察到条带(泳道 2 的 β-肌动蛋白敲除细胞裂解液)。
IHC 的对照
为了确定观察到的染色模式是真实、准确且可靠的,在 IHC 染色实验中设置对照相当重要。您应该添加抗原(组织)和试剂对照。
抗原(组织)对照
• 阳性对照:已知表达目标蛋白的组织切片。这种方法还可以验证任何阴性结果是否可信。
• 阴性对照:已知不表达靶抗原的组织切片。使用阴性对照的目的在于,检查您的抗体是否存在非特异性抗体和假阳性结果。
• 内源性组织背景对照:使用添加一抗前的组织切片。应该使用荧光或明场照明(分别用于荧光或显色标记)在显微镜下检查组织,以确保没有内源性背景。
下面是染色时使用基因敲除样本作为阴性对照的案例参考(图 2)。可以看到,Ki67 敲除的 HAP1 细胞(下图)没有表达 Ki67(绿色)。

图 2. 野生型(上图)和 Ki67 敲除 HAP1 细胞(下图)中 Ki67 抗体敲除试验的 ICC/免疫荧光法图像。绿色代表 Ki67 抗体 [EPR3610](ab92742)、山羊抗兔 IgG (Alexa Fluor® 488) 抗体(ab150081);红色代表 α-微管蛋白抗体 [DM1A](Alexa Fluor® 594)(ab195889);蓝色代表 DAPI 标记的核 DNA。
试剂对照
• 无一抗对照:组织单独与抗体稀释液孵育(无一抗),然后与二抗和检测试剂孵育,从而确保染色是由于一抗检测抗原产生的,而非由检测系统或是样本导致。
• 同型对照:用抗体稀释液以及与一抗浓度相同的同型非免疫抗体孵育组织,然后用二抗和检测试剂孵育。此对照可检验出所观察到的染色并非由抗体与组织的非特异性相互作用引起。
• 吸附对照:将组织与预吸附抗体(而非一抗)孵育,然后与二抗和检测试剂孵育。设置该对照是为了证明抗体与目标抗原特异性结合,对照染色应该很少或没有。
流式细胞术对照
使用合适的对照来改善您的流式细胞术检测结果:
• 细胞活性:死细胞可能因为非特异性结合和自发荧光水平增加,产生假信号,导致错误的结论。
• 自发荧光:天然存在的细胞组分如 NADPH 和黄素可发出掩盖抗原特异性信号的荧光。
• 光谱重叠:可以在不同的通道中检测到一个荧光团发射出的荧光。这种现象会严重影响给定通道的测量结果。
• 异常的抗体结合:当抗体与脱靶表位或 Fc 受体结合(但不作为受体 - 配体相互作用)或通过其偶联的荧光团与表位或抗原结合时,会发生这种情况。
获取流式细胞术推荐对照的完整概述。
3.3 实验优化应用,搞定。
抗体,搞定。
验证方法,搞定。
对照品,搞定。万事俱备。现在只剩最后一步:优化基于抗体的检测,以减少任何非特异性背景信号。这里需要考虑的因素包括孵育时间、封闭条件、缓冲液选择及抗体稀释。
抗体稀释抗体数据表应该提供了最佳稀释度,但这可能并不是您实验的最佳选择。因此,您应该确定产生最佳信号的抗体浓度。最实用的办法是在实验中对一系列的稀释度进行测试。 举个例子,如果产品数据表推荐的稀释度为 1/200,那么我们建议您配置以下稀释度的样本:1/50、1/100、1/200、1/400 及 1/500。
滴定实验的第一步是选择固定的孵育时间,然后确定抗体的一系列稀释度。在实验条件全部相同的情况下,基于同一类型的样本对各个稀释度进行测试。
如果您使用的是未纯化的抗体并且不知道合适的起始稀释度,可以参考下表。组织培养 SN 腹水 全抗血清 纯化的抗体 Western blot 或 dot blot 1/100 1/1000 1/500 1 µg/mL IHC/ICC 0 - 1/10 1/100 1/50-1/100 5 µg/mL EIA/ELISA 1/1000 1/10000 1/500 0.1 µg/mL FACS/流式细胞术 1/100 1/1000 1/500 1 µg/mL IP 无 1/100 1/50-1/100 1-10 µg/mL 预估浓度 1-3 mg/mL 5-10 mg/mL 1-10 mg/mL 无
EIA = 酶免疫检测;IP = 免疫沉淀反应;SN = 上清液
有必要花时间优化抗体的孵育时间、封闭剂(BSA、酪蛋白、血清、市售封闭剂等)以及您使用的缓冲液类型。这些步骤有助于产生准确的数据。
开始时多花费一点时间可能会帮您节省数周的时间。
3.4 分步实验方案这些实验方案为您提供了样本制备、抗体孵育和数据可视化步骤。为了获得最好的结果,我们还提供优化试验方案,包括抗体数据表上的推荐稀释度。
通过以下链接获取实验方案指南:
• Western blot
• 免疫组织化学
• 免疫细胞化学及免疫荧光法
• 直接 或 间接 流式细胞术
小结以上就是第 3 部分的内容。现在,您已经可以更好地进行以下操作:
• 验证您的抗体
• 选择合适的对照品
• 优化您的实验
• 使用 western blot、ICC/IF、IHC 及流式细胞术实验方案
作为本系列的最后一部分,第 4 部分将为您解答 western blot、IHC 及流式细胞术等免疫检测中遇到的常见问题,包括:没有信号/信号弱、高背景及染色不正确。我们也会提供其他应用的详细疑难解答指南,以帮助您开展正确的研究。