-
IHC 培训
第 3 部分:检测
欢迎参加我们的免疫组化(IHC)系列培训。我们将首先介绍样本制备和抗体选择等基础知识,然后再带您了解免疫染色实验方案及疑难解答提示。完成了组织处理、样本制备、抗体选择和 IHC 实验步骤的学习,现在我们来学习最有趣的部分 —— 观察结果。本部分培训中,您可以学到获取清晰准确的 IHC 图像所需的所有有用信息。
第 3 部分 概述3.1 复染剂
3.2 多重染色
3.3 封固剂
3.4 石蜡包埋切片的 IHC 视频方案
3.5 对照
3.1 复染剂在 IHC 实验中,通常会使用复染剂对组织切片中的某些结构(通常为细胞核或细胞膜)进行染色,以便观察组织及染色情况。复染剂可以是显色剂或荧光剂。
复染剂的使用尤为重要,好的复染剂产生的颜色对比度高,并且不会干扰检测中的其他试剂,例如所用色原体的颜色。
显色复染剂
• 在使用 HRP 或碱性磷酸酶与 DAB、AEC 或类似酶底物可视化一抗时,可使用显色复染剂。
• 在显色 IHC 中,最常使用的复染剂为苏木精,可将细胞核染成蓝色(图 1)。大部分苏木精染色剂既可以用于进行性染色,也可以用于退行性染色。o 进行性苏木精(例如 Mayer、Gill 及 Carazzi)孵育至观察到理想的染色程度为止。
o 退行性苏木精(例如 Harris 苏木精)起初会出现过度染色,之后将组织浸入酸液,可去除多余的染色。• 常用的核复染剂有浅绿、固红、甲苯胺蓝和亚甲基蓝;可分别将细胞核染成绿色、红色或蓝色。
• 检测核抗原时,核复染剂不要太强 —— 否则会掩盖阳性染色。
• 对于细胞质染色,通常需将伊红与苏木精搭配使用。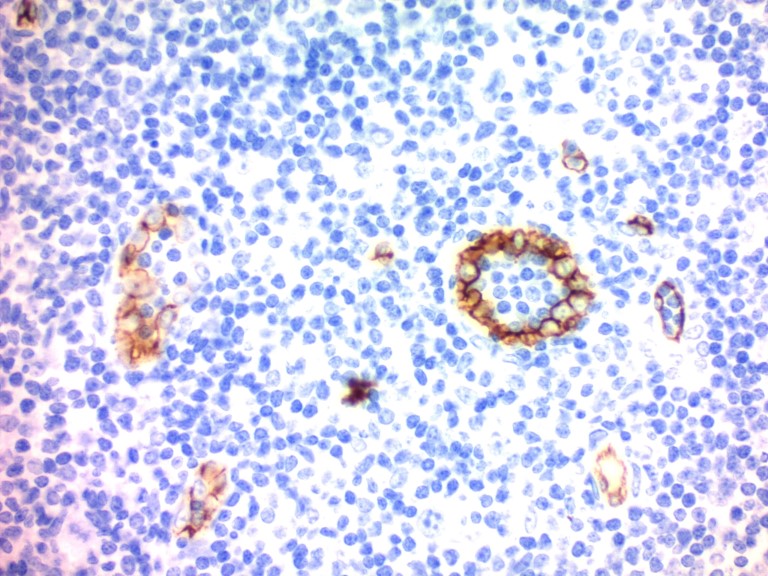
图 1. 免疫组化(福尔马林固定石蜡包埋切片)—— 苏木精溶液(Mayer,改良版)(ab220365)。使用 CD34 对人扁桃体进行免疫组化染色。用苏木精溶液(Mayer,改性)(ab220365)复染 30 秒,之后用返蓝试剂染成蓝色。
荧光复染剂
• 通过直接偶联一抗或二抗的荧光染料可视化一抗染色时,选用荧光复染剂(图 2)。
• 您可以使用 DAPI 等化学物质,或 Alexa Fluor® 偶联凝集素(例如用小麦胚芽凝集素对细胞膜进行染色)等荧光分子。
• DAPI 是最常用的荧光核复染剂,可以将细胞核染成蓝色。
• 您必须能够区分二抗(或直接偶联一抗)的信号和复染剂的信号。因此,应选用不同颜色的复染剂或者有显著差异的吸收/发射光谱检测系统。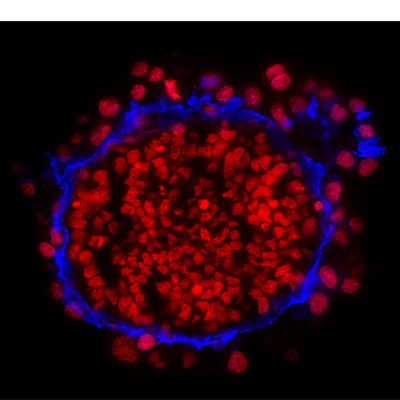
图 2. DRAQ7™染色 - 小鼠胚胎干细胞分化的胚状体冰冻切片免疫组化。使用远红外荧光染料 DRAQ7™(ab109202)复染细胞核。(由 UMDNJ-Robert Wood Johnson Medical School Shaohua Li 博士提供)
如需了解复染剂及特殊染色剂的更多信息, 请查看我们的指南。3.2 多重染色在某些情况下,多重染色可能有利于观察组织切片中两个或多个抗原的细胞定位,例如,观察蛋白是否共定位。
荧光检测常用于同时可视化多个抗原。
设计多重染色实验时,必须考虑两个关键因素:
1. 如果使用间接检测法,需避免检测试剂之间出现交叉反应(如可能)。因此通常需要选择不同种属的一抗,确保每种二抗在实验中只能识别一种一抗。
2. 选择光谱重叠最小的荧光染料。为此,我们提供了9 种不同 Alexa Fluor 染料,它们与不同种属反应的二抗偶联。
我们的视频解释了如何选择荧光染料组合。
虽然可用的荧光报告标记有很多,但荧光多色成像仍存在一些局限性:
• 两种荧光染料彼此接近时,由于能量可以从一种激发态荧光染料转移到另一种荧光染料(能量共振转移),信号可能会发生淬灭。
• 在贮存/镜检过程中,会发生荧光信号的衰减(光漂白)。
• 乙醛固定会加重样本的自发荧光。
使用能产生两种或多种终产物沉淀颜色的色原体组合时,也可以实现多色 IHC。Abcam 提供一系列多色 IHC 检测试剂盒,这些试剂盒均已经过优化,可用于多色实验,背景更低、信噪比更佳且颜色组合更灵活。
点击查看可用于荧光 IHC 的 Alexa Fluor 二抗。
了解关于多重显色 IHC 试剂盒的更多信息。
3.3 封固剂IHC 染色后,使用封固剂将盖玻片黏附在组织切片或细胞涂片上。组织样本封固对样本保存及显微成像质量的提高至关重要。
封固剂有两类:有机(疏水性)封固剂和水性(亲水性)封固剂。有机封固剂只能用于酶学标记,在此情况下,酶与色原体产生的沉淀(例如二氨基联苯胺DAB)不溶于封固组织期间使用的有机溶剂。水性封固剂通常适用于所有酶学标记物/色原组合及荧光标记物。
查看我们推荐用于荧光成像和非荧光成像的封固剂。
3.4 石蜡包埋切片的 IHC 视频方案现在,您已经了解了 IHC 实验的主要步骤,下面的视频将从头到尾为您详细介绍石蜡包埋切片的完整 IHC 实验方案。

3.5 对照和其他实验一样,为了确保观察到的染色结果真实、准确、可靠,在 IHC 染色中设置对照相当重要。对照分为两类:
• 抗原(组织)对照
• 试剂对照
抗原组织对照
• 阳性对照:已知表达目标蛋白的组织切片。即使样本结果为阴性,阳性对照的阳性结果仍可以表明实验程序及试剂有效且经过优化。同时证实任何阴性结果的有效性。
• 阴性对照:已知不表达靶抗原的组织切片。使用阴性对照的目的是检查是否存在非特异性信号和假阳性结果。
• 内源性组织背景对照:加入一抗前的组织切片。某些组织具有导致背景染色的固有特性,可能会影响结果分析。比如某些组织有内源性荧光分子,可能会在荧光 IHC 过程中与阳性染色混淆。应使用荧光或明场照明(分别用于荧光或显色标记)在显微镜下检查组织,确保没有内源性背景。
下面是使用基因敲除组织作为 IHC 染色阴性对照的案例参考(图 3)。可以看到,TMEM119 敲除的小鼠脑组织(下图)不表达 TMEM119(红色)。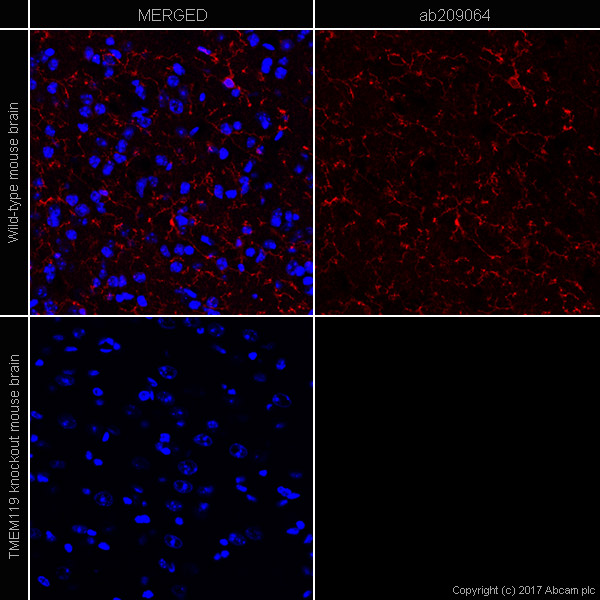
图 3. TMEM119(ab209064,小胶质细胞标志物)的免疫组化染色 - 野生型正常小鼠脑组织(上排)与 TMEM119 敲除小鼠脑组织(下排),两图均为冷冻脑组织切片 。红色是 TMEM119 抗体(ab209064)与山羊抗兔 IgG H&L(Alexa Fluor® 647)(ab150087);蓝色是用 DAPI 标记的核 DNA。
试剂对照
• 无一抗对照:组织单独与抗体稀释液孵育,不与一抗孵育,然后与二抗和检测试剂孵育。从而确保染色是由于一抗检测抗原产生的,而非由检测系统或是样本导致。
• 同型对照:用抗体稀释液以及与一抗浓度相同的同型非免疫抗体孵育组织,然后用二抗和检测试剂孵育。此对照可检验出所观察到的染色并非由抗体与组织的非特异性相互作用引起。用同型对照观察到的背景染色可以忽略,且与特异性染色存在区别。使用单克隆一抗时,可以使用这种对照。
• 吸附对照:将组织与预吸附抗体(而非一抗)孵育,然后与二抗和检测试剂孵育。设置该对照是为了证明抗体与目标抗原特异性结合,预期中对照染色很少或没有。预吸附抗体可通过在 4℃ 下用过量(10 倍)免疫原过夜孵育抗体制备。如果免疫原为多肽,组织中的抗体-蛋白免疫原混合物可能会因蛋白与组织之间的非特异性反应而产生高背景染色,此时使用吸附对照更为可靠。
小结现在,您应该掌握了进行以下操作的所有信息:
• 复染
• 单色或多重免疫染色
• 组织封固
• 选择合适的 IHC 对照
在第 4 部分,我们将讨论您在 IHC 实验中可能遇到的最常见问题和事件的解决办法。
现在开始学习第 4 部分吧!