-
IHC 培训
第 2 部分:免疫染色
欢迎参加我们的免疫组化(IHC)系列培训。我们将首先介绍样本制备和抗体选择等基础知识,然后再带您了解免疫染色实验方案及疑难解答提示。在 IHC 培训的第 2 部分,您将学习如何进行组织染色。我们将讲解 IHC 的实验步骤,例如抗原修复、通透及封闭。同时,我们还会讨论如何选择合适的一抗和二抗,以及选用何种检测系统可以获得最佳结果。
第 2 部分 概述2.1 抗原修复
2.2 通透
2.3 封闭
2.4 一抗的选择及直接检测法与间接检测法
2.5 二抗的选择
2.1 抗原修复大多数福尔马林固定的组织在用一抗孵育之前需要进行抗原修复。这是因为用乙醛固定组织过程中,固定剂与组织蛋白之间会发生交联,从而掩盖抗原表位。抗原修复可以破坏这些桥连,暴露出抗原位点,使抗体与对应的靶蛋白结合。抗原修复方法有两种,分别为热诱导抗原表位修复(HIER)和酶/蛋白水解抗原表位修复(PIER)。
以下视频介绍了 HIER 和 PIER 的主要区别。
两种抗原修复法的优缺点如下:
• HIER 表位修复更温和,可确定参数更多,但加热过程中会形成热点和冷点,可能导致表位修复不均衡,并且剧烈沸腾会导致组织从载玻片上脱落。
• PIER 适用于较难修复的表位,但酶法修复有时会损伤组织形态(需要优化浓度及修复时间)。
最佳的抗原修复法取决于组织类型、固定方法和一抗。选择合适的抗原修复法时,需要首先对两种 HIER 法(例如用 pH 值为 6 的柠檬酸盐缓冲液和 pH 值为 9 的 Tris-EDTA 缓冲液)以及一种或两种 PIER 法(例如用 proteinase K 和/或 trypsin)进行测试。冰冻切片可能不需要抗原修复,因为乙醛固定时间非常短(10 - 30 分钟),不会形成交联。
图 1 表明优化抗原修复可以改善染色。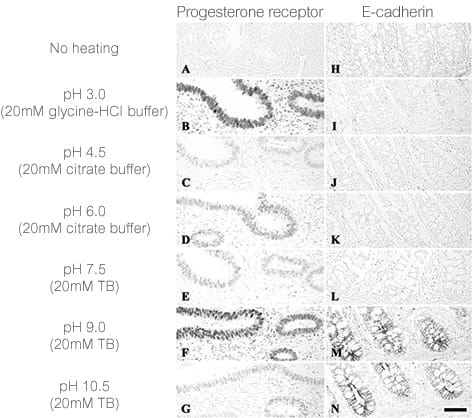
图 1. pH 对人体组织中热诱导抗原修复的影响。参见 Emoto, et al. Mechanisms of heat-induced antigen retrieval: does pH or ionic strength of the solution play a role for refolding antigens? J Histochem Cytochem 53, 1311–1321 (2005).
了解本指南中关于抗原修复法的更多信息。
获取抗原修复实验方案。2.2 通透当抗体需要进入细胞内部检测靶抗原时,需要进行通透处理。这类抗原包括细胞内蛋白和跨膜蛋白的胞质表位。溶剂或去污剂通常用于通透。
采用甲醛等交联剂固定后,可以使用溶剂进行通透—— 推荐用于细胞骨架、病毒和一些酶抗原。
作用剧烈的去污剂(如 Triton™ X-100 或 NP-40)可能会破坏蛋白,也有部分去污剂较温和(如 Tween 20®、皂素或毛地黄皂苷),不会溶解质膜。去污剂通透能够显著提高抗体与细胞质中抗原、质膜胞质面抗原以及可溶性核抗原的结合作用。
溶剂和去污剂指南溶剂 评价 溶剂 丙酮 丙酮固定也具有通透作用 甲醇 甲醇固定可用于通透,但不一定有效 去污剂 Triton™ X-100 或 NP-40 在 PBS 中配制含 0.1% - 0.2% 溶剂的溶液,仅需通透 10 分钟 Tween 20®、皂素、毛地黄皂苷和 Leucoperm 使用浓度为 0.2% - 0.5% 的溶剂,通透10 - 30 分钟
2.3 封闭使用血清或蛋白封闭试剂进行封闭是防止抗体与组织或 Fc 受体(结合抗体恒定区(Fc)的受体)发生非特异性结合的必要手段。封闭可以降低背景信号并减少假阳性结果。
封闭方法包括:
• 使用 BSA(牛血清白蛋白)蛋白或血清进行封闭,可以防止抗体与组织或 Fc 受体发生非特异性结合。
• 使用生物素标记二抗时,需使用生物素进行封闭,即先使用亲和素预孵育组织,然后与生物素一起孵育,从而封闭亲和素分子上的其它生物素结合位点。
• 采用显色检测法时,需要封闭内源性酶(封闭内源性过氧化物酶)。
观看下面的视频,了解如何实现有效封闭。
您可以阅读我们的完整 IHC 封闭指南,了解关于各种封闭法优点和局限性的更多信息。
2.4 一抗的选择及直接检测法与间接检测法免疫染色(或免疫检测)依赖于一抗和靶抗原的特异性结合。对于可与目标抗原结合的一抗,可以用直接检测法,也可以用间接检测法检测。直接检测法中,一抗与标记直接偶联。使用间接检测法时,一抗需要与抗一抗来源宿主种属的标记二抗结合。
两种方法都可以通过荧光标记或催化可溶性底物生成不溶性显色产物的酶进行抗体可视化。
以下视频介绍了成功进行免疫染色所需的所有步骤:
• 如何选择理想的一抗
• 何时使用直接检测法和间接检测法
• 如何选择显色标记和荧光标记
下载我们的石蜡切片、冷冻切片和自由浮动式切片的 IHC 染色方案。
2.5 二抗的选择在为 IHC 实验选择二抗时,需要考虑以下几点:
• 生物素偶联物(图 2)可以放大信号(需使用 ABC 复合物),确保能够检测出低丰度蛋白,因此一直是被广泛使用的二抗。
• HRP 聚合物二抗可以避免 IHC 实验中内源性生物素产生的背景,极大地放大信号。
• 预吸附二抗用于多色分析,可确保低种属交叉反应性。
• 片段抗体更小且可高效渗入组织。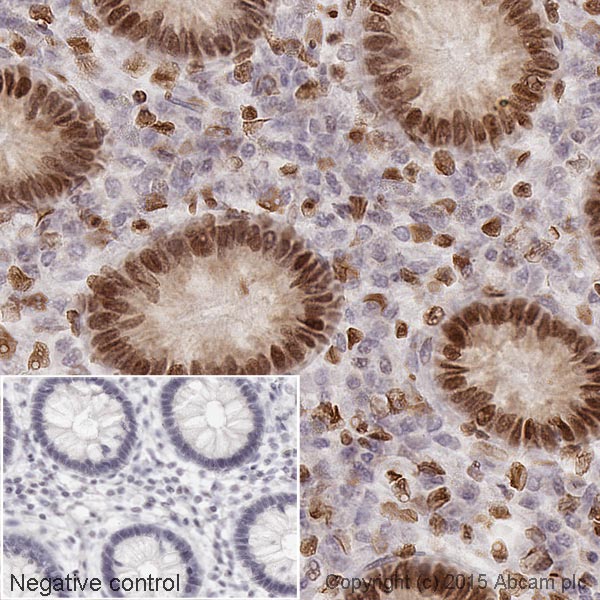
图 2. 山羊抗小鼠 IgG H&L(生物素)(ab6788)。组蛋白 H1 的免疫组化染色 - 人正常结肠组织(福尔马林固定石蜡包埋切片)。在高压锅中用柠檬酸钠缓冲液(pH 6)对切片进行 30 分钟热介导的抗原修复。随后用稀释度为 1/1000 的 ab11080 在室温下孵育切片 15 分钟。使用山羊抗小鼠生物素化二抗(ab6788,1/1000)检测一抗,并用 HRP 偶联 ABC 系统可视化结果。使用链霉亲和素 HRP(ab7403,1/10,000)。使用 DAB 作为色原体(ab103723,1/100),室温下孵育 10 分钟。然后用苏木精复染切片,并用 DPX 封片。
点击查看完整的 IHC 二抗指南。
小结现在,您应该已经完全了解了 IHC 的染色步骤,包括:
• 抗原修复的两种主要方法
• 直接检测法与间接检测法、显色法与荧光标记法的区别
• 选择一抗和二抗的主要注意事项
在第 3 部分,我们将介绍复染剂、多重染色以及如何封片才能得到大家梦寐以求的出色 IHC 图像。我们还将讨论如何选择合适的对照,确保您获得准确、可信的结果。
现在开始学习第 3 部分吧!